


花菁染料是一类具有共轭多甲川链(-CH=CH-)ₙ的合成有机荧光染料,其独特的结构赋予了其优异的光物理性质,包括高摩尔消光系数、可调的发射波长和适中的荧光量子产率。自19世纪中叶被发现以来,花菁染料已从最初的照相增感剂发展为现代生命科学、医学成像和材料科学中不可或缺的工具。

蛋白免疫印迹技术的雏形可以追溯到1970年代,当时W. M. Kelley与M. J. Bennett首次将电泳分离的蛋白与抗体特异性结合的概念联系起来,用于检测血清中的病毒抗原。

核酸凝胶电泳是分子生物学实验室中分离、鉴定和纯化核酸(DNA/RNA)的核心技术之一,其原理基于核酸分子在电场中因分子量、构象差异产生的迁移速率不同,最终实现分离。该技术广泛应用于PCR产物验证、质粒酶切鉴定、核酸纯度分析等场景。核酸染料在凝胶电泳技术中起着至关重要的作用,它们能够特异性地与DNA或RNA分子结合,使得在电泳过程中迁移的核酸条带在适宜的激发光源下清晰可见。

TSA多色免疫荧光技术起源于免疫组织化学与免疫荧光检测灵敏度不足这一长期存在的技术瓶颈。20 世纪90年代初,Bobrow等人首次系统提出并验证了“酪胺信号放大(Tyramide Signal Amplification, TSA)”策略,其核心思想是利用辣根过氧化物酶(horseradish peroxidase, HRP)催化酪胺类底物在靶分子邻近区域发生共价沉积,从而显著增强检测信号。

在细胞生物学与医学研究中,亚细胞结构的可视化是阐明细胞功能、信号传导以及病理改变的核心手段。随着荧光染料、抗体标记以及高分辨率显微技术的快速发展,研究者能够在活细胞或固定细胞水平上,对细胞骨架、线粒体、高尔基体、细胞核、溶酶体、细胞膜以及神经元特有的突触结构等关键细胞器进行精准定位、动态追踪和定量分析。以下分别对这些亚细胞结构的组成、主要生理功能以及常用的染色/成像策略进行系统阐述,以期为实验设计提供完整的理论与技术参考。

细胞周期 (cell cycle)是指细胞从上一次分裂完成到下一次分裂结束所经历的全部过程,包括分裂间期和分裂期(M期),其中分裂间期又可分为DNA合成前期 (G1期)、DNA合成期 (S期)、DNA合成后期(G2期)。G0期是细胞静止期,它们暂时脱离细胞周期,停止细胞分裂,但在一定条件的刺激下,又可重新进入细胞周期进行分裂。
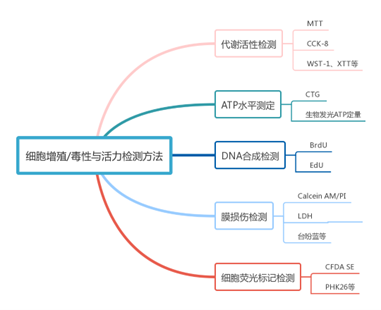
细胞活力(Cell viability)检测是通过总细胞中活细胞的百分比,直观反映细胞群体的存活状态,排除因衰老、损伤、环境胁迫等因素死亡的细胞后,剩余具有生理活性细胞的占比,是对细胞群体存活能力的量化描述。作为判断体外培养细胞是否能正常生长的关键指标,其核心作用是评估外界干预对细胞的影响:比如检测药物处理后细胞是否因毒性死亡、放射性/紫外线照射是否损伤细胞活力、培养温度/营养等条件变化是否影响细胞存活,最终为实验(如药物筛选、毒性测试、细胞培养优化)提供细胞是否能正常生长的判断依据。
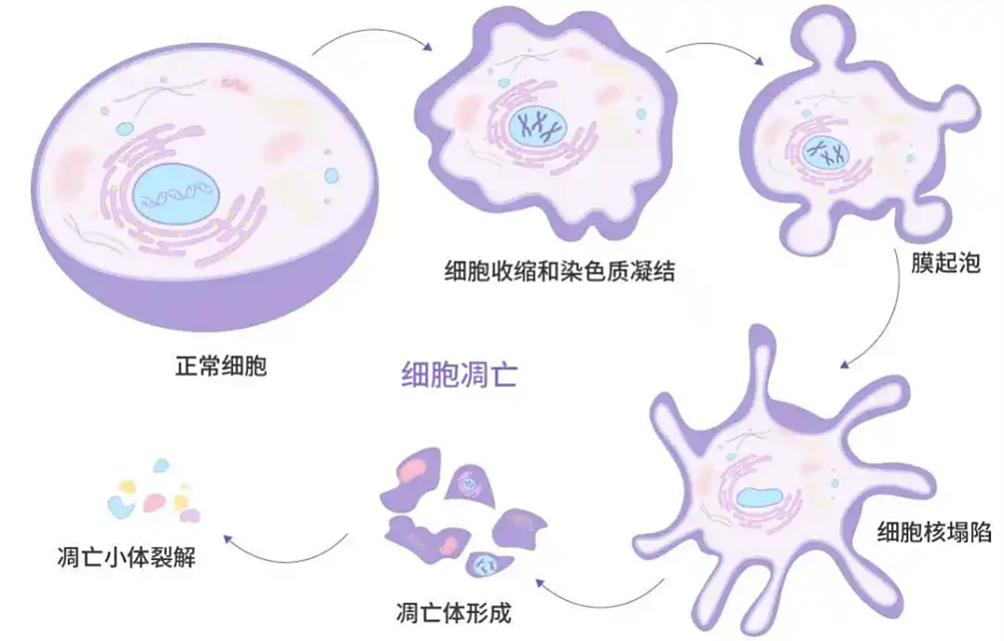
荧光染料在细胞凋亡研究中扮演着至关重要的角色,提供了从早期到晚期、从定性到定量的多维度检测手段,其核心价值在于能够非侵入性或低侵入性地、实时动态地揭示凋亡过程的特异性生化与形态学事件。

荧光染料是一类在特定波长光激发下能够发射出更长波长荧光的化合物。其结构通常由共轭π电子系统(如芳香环、多烯链)构成发色团,并通过引入给电子或吸电子基团(如氨基、硝基)调节荧光性质,部分染料还含有反应性基团(如NHS酯、马来酰亚胺)以实现与生物分子的特异性偶联。
荧光染料的核心优势在于其能够实现单分子水平检测,且通过多色标记可同时追踪多个靶标,极大提升了分析的维度和效率。相较于传统染色方法(如化学发光或放射性标记),荧光染料具备低的生物毒性、便捷的实时动态观测能力以及丰富的颜色选择,因此在生命科学研究中具有不可替代的价值。

在人类与癌症旷日持久的抗争进程中,药物设计与开发始终是关键战场。抗体偶联药物(ADC)横空出世,为这一领域注入了全新活力,成为推动创新的核心驱动力,彻底革新了癌症治疗药物的研发格局。
 扫码关注公众号
扫码关注公众号